Hurtig oppsummering
koblet papir (fra 1975) er sannsynligvis feil . Et litt nyere papir ( J. Am. Chem. Soc., 1989, 111 (21), s. 8112–8115) antyder at obligasjonslengdene er omtrent like store. Noen raske beregninger (nedenfor) ved bruk av flere moderne metoder antyder at, som forventet, CS-obligasjonslengden i $ \ ce {CH2SH -} $ er kortere enn i $ \ ce {CH3SH} $.
For begge eldre papirer vil beregningsresultatene (ved hjelp av grunnleggende Hartree Fock) bli ansett som svært mistenkelige under moderne fagfellevurdering, siden Hartree Fock er kjent for å ha problemer med anioner. Absolutt nevner 1975-papiret ikke engang basis settet.
Sett nedenfor, er det klart at resultatene er metodeavhengige, men den beste nåværende metoder, med rimelige basissett, indikerer at bindingslengden er minst litt kortere på grunn av noe delvis dobbeltbindingskarakter.
Flere detaljer
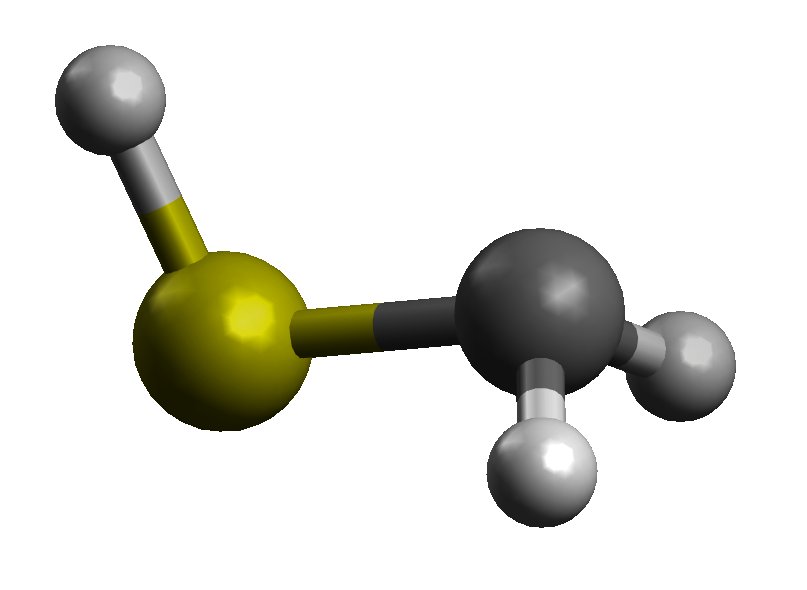
Den første tingen å vurdere i dette er at det er to former for $ \ ce {CH2SH -} $, syn og anti , basert på retningen til den formelt C-bundne anionen og SH-gruppen:
syn form
anti form
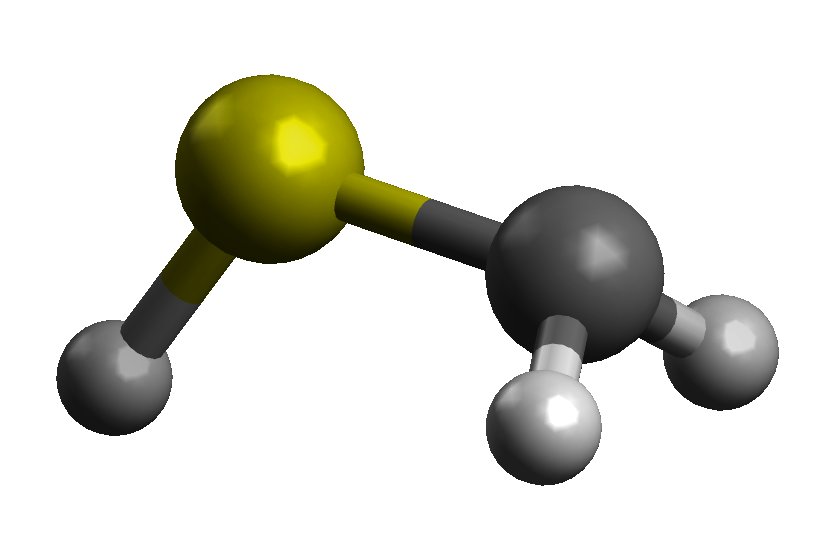
Disse vil ha forskjellige bindingslengder, siden anti skjemaet vil ha bidrag fra resonansstrukturer II og III fra Rons svar . Dette gir noe dobbeltbindingskarakter og bør sannsynligvis ha en kortere binding, selv om elektrostatisk frastøtelse også kan påberopes.
Formen syn vil ikke ha en klar effekt, siden C anion ensomme par og S ensomme par er på motsatt side av bindingen. Jeg antar at obligasjonslengden er omtrent den samme som $ \ ce {CH3SH} $.
Jeg tror den klare meldingen er at vi kan forklare mange ting, men det er bedre å vite om resultatene våre er nøyaktige før du prøver å forklare dem.
Det jeg ser med mer moderne beregningsmetoder er at skjemaet syn har lignende CS-bindingslengde til $ \ ce {CH3SH} $, og anti -formen er litt kortere . Jeg mistenker at forrige resultat ganske enkelt er feil . Beregninger som involverer anioner er vanskelige, siden ekstra elektronet vanligvis er svært diffust. Jeg forventer at basissettet rett og slett ikke var tilstrekkelig.
Forskjellen i energi mellom de to formene er ~ 1 kcal / mol, så eksperimentelt vil disse konvertere lett, og en gjennomsnittlig bindingslengde vil bli observert. Som nevnt i kommentarene, vil denne arten trolig være vanskelig å observere, selv i gassfasen, siden $ \ ce {CH3S -} $ er mer stabil.
Beregnede CS-bindingslengder (i Å):
For alle metoder ble optimal geometrioptimalisering utført ved hjelp av de angitte metodene. Jeg vil anse CCSD-beregningene for å være av høy kvalitet.